
TECARTUS® är avsett för behandling av vuxna patienter med recidiverat eller refraktärt mantelcellsymfom (MCL) efter två eller fler linjers systemisk behandling med bland annat en Brutons tyrosinkinashämmare (BTK-hämmare). 1
Den andra CAR T-produkten i Kite-portföljen, TECARTUS®, godkändes för behandling av recidiverande eller refraktärt mantelcellslymfom i december 2020.
Effekt och säkerhet för Tecartus hos vuxna patienter med recidiverande eller refraktärt MCL som tidigare hade fått antracyklin- eller bendamustinbaserad kemoterapi, en anti-CD20-antikropp och en Bruton’s tyrosinkinashämmare (BTKi) (ibrutinib eller acalabrutinib), utvärderades i en fas 2-studie med enarmad, öppen design och flera centra (ZUMA-2). I studien behandlades 68 patienter med Tecartus. Det primära effektmåttet var objektiv responsfrekvens (ORR); sekundära effektmått inkluderade duration av respons (DOR), totalöverlevnad (OS), progressionsfri överlevnad (PFS) samt svårighetsgrad av biverkningar.¹ ²
Den primära effektanalysen visade att 93 % (95 % konfidensintervall [KI], 84 till 98) av de 60 patienter som ingick i den primära effektanalysen hade en objektiv respons; 67 % (95 % KI, 53, 78) hade en komplett respons.¹ ²
De uppdaterade uppföljningsanalyserna vid 24 månader av effekt genomfördes med den modifierade intent-to-treat-analysgruppen (mITT), som bestod av 68 patienter behandlade med Tecartus. I uppföljningsanalysen vid 24 månader var ORR och CR-frekvensen hos de 68 patienterna i mITT-gruppen 91 % respektive 68 %.¹
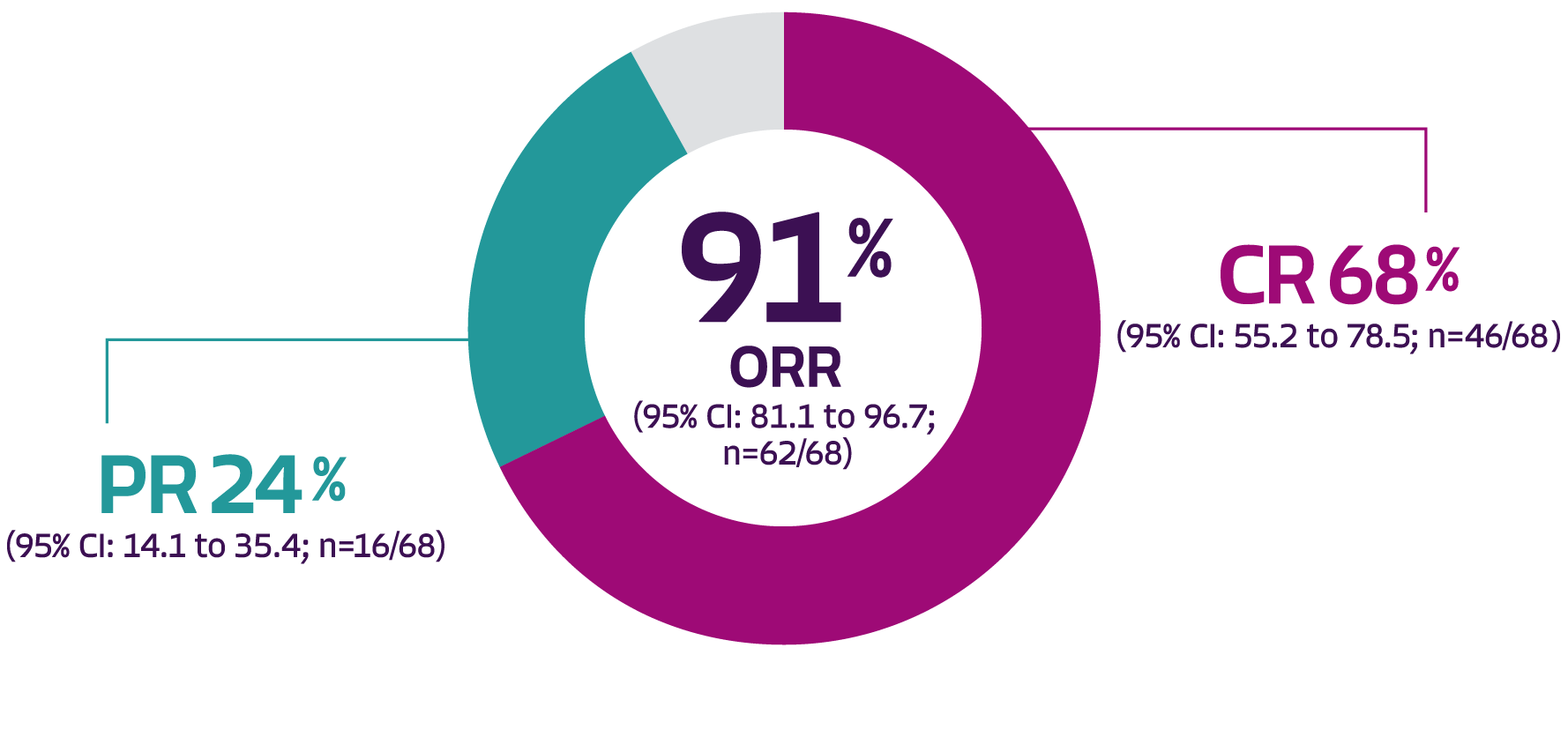
ORR, CR and PR from the 24-months follow-up (mITT, N=68), where the median follow-up among all 68 treated patients was 35.6 months. Figure adapted from the SmPC.¹
Efter en medianuppföljning på 35,6 månader uppnåddes en median OS på 46,6 månader med Tecartus® i den högrisk- och tungt förbehandlade patientpopulationen i ZUMA-2-studien. Median DOR var 28,2 månader (95 % KI, 13,5 till 47,1).³

Säkerhetsdata från ZUMA-5 återspeglar exponering för Yescarta i en fas 2-studie med 119 patienter med recidiverande/refraktärt FL.¹
De säkerhetsdata som beskrivs i detta avsnitt återspeglar exponering för Tecartus i ZUMA-2, en fas 2-studie med totalt 82 patienter med recidiverande/refraktärt MCL.
De mest betydande och frekvent förekommande biverkningarna var CRS (91 %), infektioner (55 %) och encefalopati (51 %).
Allvarliga biverkningar förekom hos 56 % av patienterna. De vanligaste allvarliga biverkningarna inkluderade encefalopati (26 %), infektioner (28 %) och cytokine release syndrome (15 %).¹
Se produktresumén för fullständig information om Tecartus säkerhetsprofil.

▼ Detta läkemedel är föremål för utökad övervakning.
TECARTUS® (brexukabtagen-autoleucel), 0.4 – 2 × 108 celler infusionsvätska, dispersion. Rx, EF. ATC-kod: L01XL06. Indikationer: Behandling av vuxna patienter med recidiverande eller refraktärt mantelcellsymfom (MCL) efter två eller fler linjers systemisk behandling med bland annat en Brutons tyrosinkinashämmare (BTK-hämmare). Behandling av vuxna patienter 26 år och äldre med recidiverande eller refraktär B-cellsprekursor akut lymfatisk leukemi (ALL). Måste administreras på en kvalificerad behandlingsenhet av en läkare som har erfarenhet av behandling av hematologiska maligniteter och är utbildad i administrering och hantering av patienter som behandlas med Tecartus. Kontraindikationer: Överkänslighet mot den aktiva substansen eller hjälpämne. Kontraindikationer mot den lymfocytreducerande kemoterapin måste beaktas. Varningar och försiktighet: Infusionen måste skjutas upp om en patient har något av följande tillstånd: Kvarstående allvarliga biverkningar (särskilt lungreaktioner, hjärtreaktioner eller hypotoni) inklusive från föregående kemoterapier, aktiv okontrollerad infektion eller inflammatorisk sjukdom eller aktiv transplantat-mot-värdsjukdom (GVHD). Cytokinfrisättningssyndrom: Nästan alla patienter upplevde någon form av CRS. Svår CRS, vilket kan vara dödlig, observerades med Tecartus med en debuttid på 1–13 dagar efter infusionen. Minst 1 dos av tocilizumab för användning vid cytokinfrisättningssyndrom (CRS) samt akututrustning måste vara tillgänglig när infusionen inleds. Den kvalificerade behandlingsenheten måste ha tillgång till ytterligare en dos tocilizumab inom 8 timmar från varje föregående dos. Patienter bör övervakas dagligen under de första 7 dagarna efter infusion, för tecken och symtom på CRS, neurologiska biverkningar och andra toxiciteter. Rekommendera patienterna att stanna kvar i närheten av en kvalificerad klinik under minst 4 veckor efter infusionen och att söka omedelbar läkarvård om tecken eller symtom på CRS eller neurologiska biverkningar uppträder vid någon tidpunkt. Allvarliga neurologiska biverkningar vilka kan vara livshotande eller dödliga, har observerats hos patienter som fått behandling med Tecartus. Behandlingsalgoritmer har utvecklats för att lindra CRS och de neurologiska biverkningarna. Patienterna bör övervakas med avseende på tecken och symptom på infektion, före, under och efter infusion, och behandlas på lämpligt sätt. Innehavare av marknadsföringstillståndet: Kite Pharma EU B.V., Nederländerna. För information: Kontakta Gilead Sciences Sweden AB, 08 505 718 00. Vid förskrivning och för aktuell information om förpackningar se www.fass.se. Baserat på produktresumé 11/2025.
SE-COR-0074 12/2025