
YESCARTA® är avsett för behandling av vuxna patienter med diffust storcelligt B-cellslymfom (DLBCL) och höggradigt B-cellslymfom (HGBL) som recidiverat inom 12 månader efter avslutad, eller är refraktärt till, första linjens kemoimmunterapi 1.
Yescarta godkändes av EU för behandling av 2L R/R DLBCL i oktober 2022.
Yescarta rekommenderas från och med januari 2024 av NT-rådet för användning vid 2L R/R Diffust storcellig B-cellslymfom (DLBCL) enligt produktresumén. Rekommendationen från NT-rådet lyder:
"NT-rådet rekommenderar Yescarta® för behandling av vuxna patienter med DLBCL och höggradigt B-cellslymfom (HGBL) som återfaller inom 12 månader efter avslutad, eller är refraktära mot, behandling med kemoimmunoterapi i första linjen."
Effekten och säkerheten hos Yescarta hos vuxna patienter med r/r DLBCL demonstrerades i en fas 3 randomiserad, öppen multicenterstudie (ZUMA-7). ZUMA-7 är den största fas 3 CAR T-studien för 2L DLBCL (N=359) med den längsta uppföljningsperioden hittills (medianuppföljning 24,9 månader). Totalt randomiserades 180 patienter till att få Yescarta och 179 patienter till att få standardbehandling (SOCT, definierad som forskarvald kemoinmunoterapi med avsikt att gå vidare till högdoskemoterapi med autolog stamcellstransplantation). Det primär utfallsmåttet var eventfri överlevnad (EFS) bedömd genom blindad central granskning 1,3.
Mer än dubbelt så många patienter som behandlats med YESCARTA är eventfria efter 2 år jämfört med SOCT.1,2
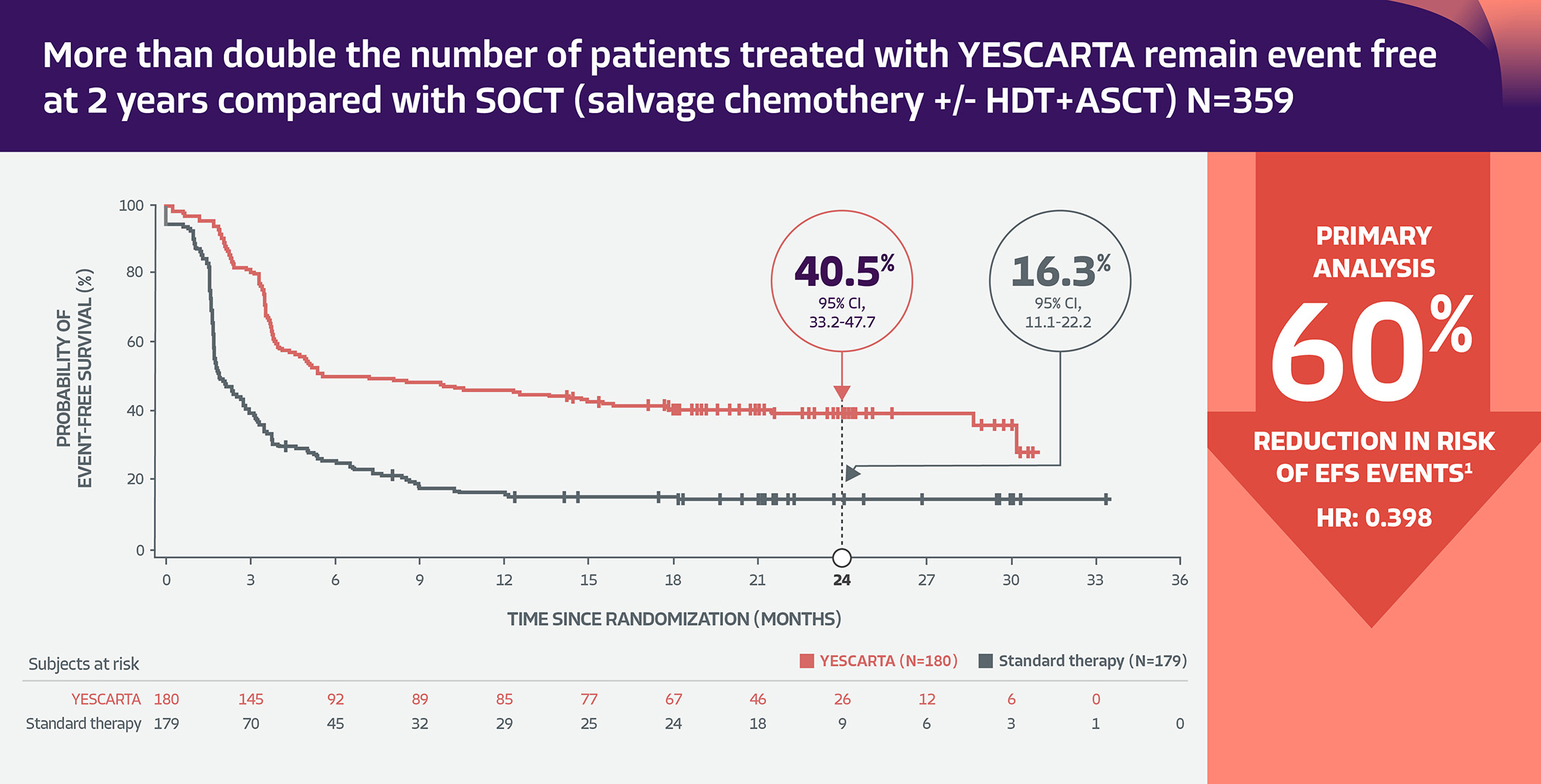
ZUMA-7 primära effektmåttsresultat. Data från Locke et al. 2022²
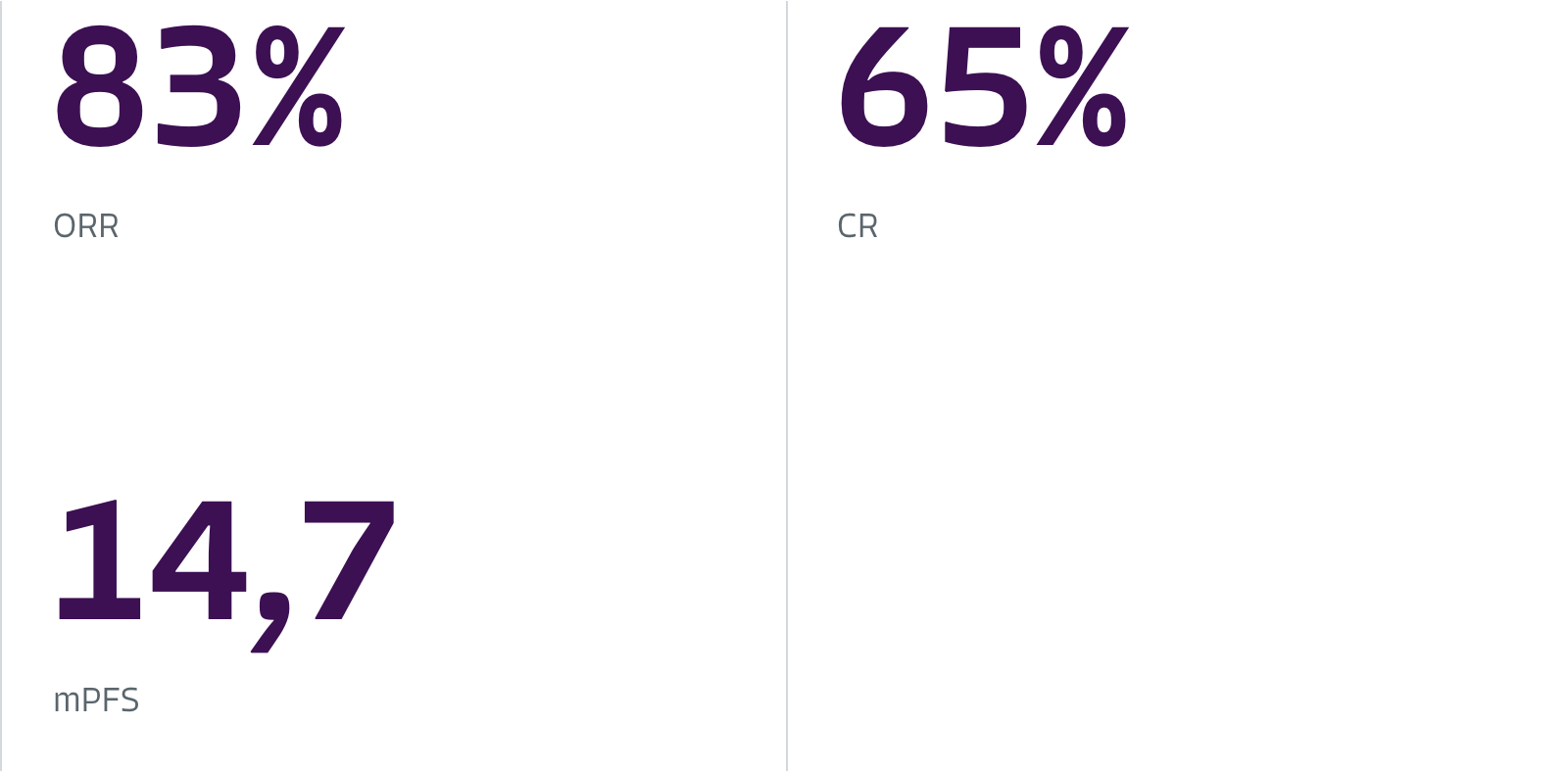
ORR var signifikant högre med YESCARTA® jämfört med SOCT (83% mot 50%; P<0,001), med ett komplett svar som observerades hos 65% respektive 32% av patienterna.
Median PFS var fyra gånger högre hos YESCARTA®-patienter jämfört med SOCT (14,7 månader mot 3,7 månader).
Yescarta® är den enda CAR T som har visat signifikant förbättrad totalöverlevnad (OS) jämfört med standardbehandling vid 2L DLBCL R/R ≤12 månader jämfört med standardvård (SOCT, definierat som salvage-kemoterapi +/- högdoskemoterapi och autolog stamcellstransplantation, ASCT) i den kurativa inställningen3
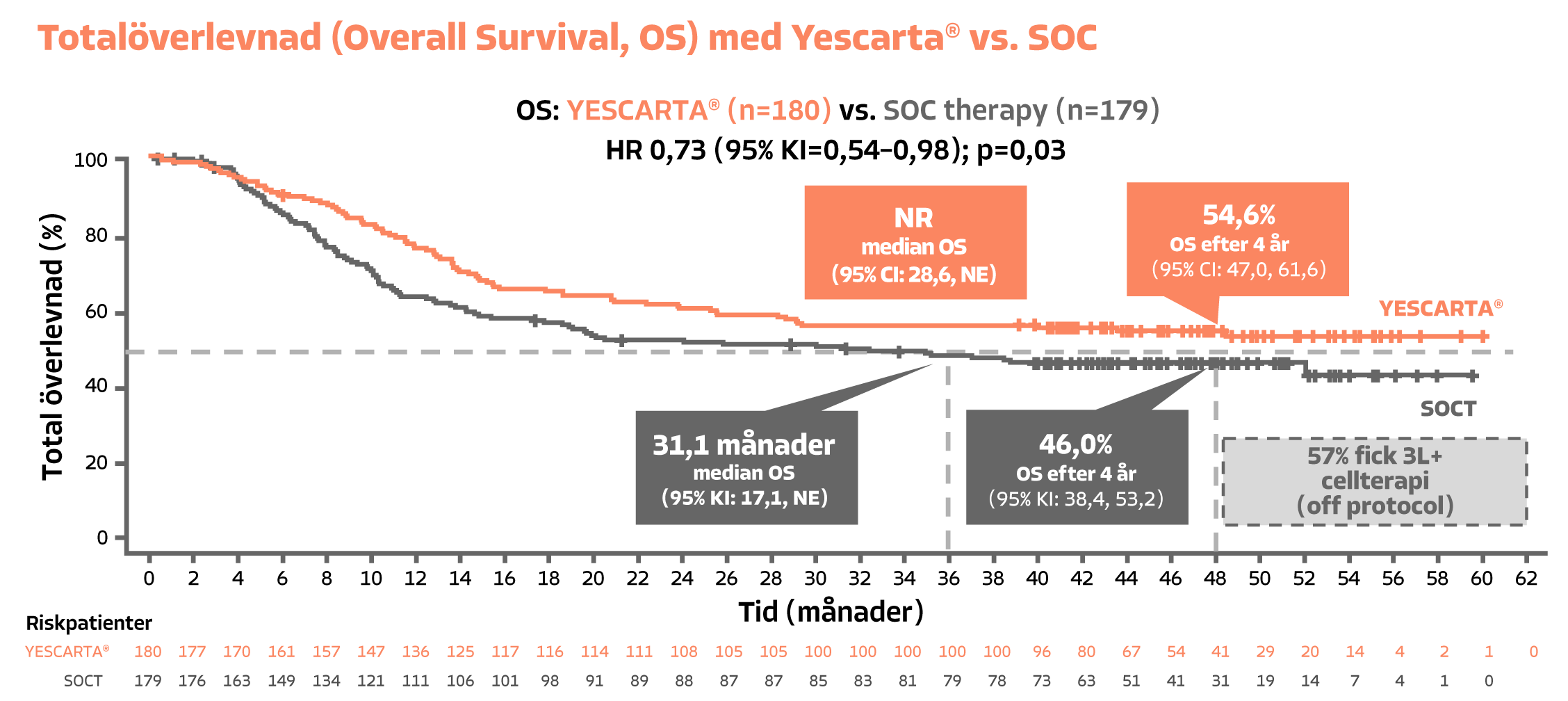
Figure created by Gilead based on Westin et al. NEJM (2023)
Säkerhetsdata för Yescarta vid 2L DLBCL är i linje med tidigare resultat från 3L DLBCL-studier (ZUMA-1).1,3
Säkerhetsdata från ZUMA-7 återspeglar exponering för Yescarta i en fas 3-studie för 170 patienter.
De mest betydande och frekvent förekommande biverkningarna var CRS (92%), encefalopati (49%) och infektioner (45%). Allvarliga biverkningar förekom hos 54% av patienterna. De vanligaste (≥5%) allvarliga biverkningarna inkluderade CRS (17%), encefalopati (16%), ospecificerade patogeninfektioner (8%), feber (6%) och virusinfektion (5%). 1,3
Vänligen se produktresumén för fullständig information om YESCARTA®s säkerhetsprofil.1
a Hazard ratio [HR] 0.73; 95 % CI: 0.54–0.98, stratified two-sided log-rank, P-value = 0.03.3

▼ Detta läkemedel är föremål för utökad övervakning.
YESCARTA® (axikabtagenciloleucel), 0,4–2 x 108 celler infusionsvätska, dispersion. Rx. EF. ATC-kod: L01XL03. Indikationer: Behandling av vuxna patienter med diffust storcelligt B-cellslymfom (DLBCL) och höggradigt B-cellslymfom (HGBL) som recidiverat inom 12 månader efter avslutad, eller är refraktärt till, första linjens kemoimmunterapi. Behandling av vuxna patienter med recidiverat eller refraktärt diffust storcelligt B-cellslymfom (DLBCL) och primärt mediastinalt storcelligt B-cellslymfom (PMBCL), efter två eller fler linjer av systemisk terapi. Behandling av vuxna patienter med recidiverat eller refraktärt follikulärt lymfom (FL) efter tre eller fler linjer av systemisk terapi. Yescarta-behandling ska initieras och övervakas av hälso-och sjukvårdspersonal som har erfarenhet av behandling av hematologiska maligniteter och är utbildad i administrering och hantering av patienter som behandlas med Yescarta. Kontraindikationer: Överkänslighet mot den aktiva substansen eller hjälpämne eller mot gentamicin (eventuella spårrester). Kontraindikationer mot den lymfocytreducerande kemoterapin måste beaktas. Varningar och försiktighet: Infusionen ska skjutas upp om en patient har något av följande tillstånd: Kvarstående allvarliga biverkningar (särskilt lungreaktioner, hjärtreaktioner eller hypotoni) inklusive från föregående kemoterapier, aktiv okontrollerad infektion, aktiv transplantat-mot-värdsjukdom (graft-versus-host disease, GvHD). Cytokinfrisättningssyndrom: Nästan alla patienter upplevde någon form av CRS. Svår CRS, inklusive livshotande och fatala reaktioner, observerades mycket ofta med Yescarta, med en debuttid på 1 till 12 dagar efter infusionen. Innan en Yescarta-infusion inleds måste minst 1 dos tocilizumab per patient finnas på plats och vara tillgänglig för administrering. Behandlingsenheten måste ha tillgång till ytterligare en dos tocilizumab inom 8 timmar från varje föregående dos. Övervaka patienter dagligen avseende tecken och symtom på CRS under minst 7 dagar efter infusion vid den kvalificerade kliniken. Patienterna måste stanna kvar i närheten av en kvalificerad klinik under minst 4 veckor efter infusionen och söka omedelbar läkarvård om tecken eller symtom på CRS uppträder vid någon tidpunkt. Svåra neurologiska biverkningar, som kan vara livshotande eller fatala, har observerats mycket ofta hos patienter som behandlats med Yescarta. Behandlingsalgoritmer har utvecklats för att lindra CRS och de neurologiska biverkningarna. Patienter måste övervakas med avseende på tecken och symtom på infektion före, under och efter infusion, och behandlas på lämpligt sätt. Innehavare av marknadsföringstillståndet: Kite Pharma EU B.V., Nederländerna. För information: Kontakta Gilead Sciences Sweden AB, 08 505 718 00. Vid förskrivning och för aktuell information om förpackningar se www.fass.se. Baserad på produktresumé: 07/2025.
SE-COR-0074 12/2025